Pharmacovigilance : on a besoin de vous !

 Imaginons un nouveau médicament appelé «Lutteur-Douleur» qui est une prometteuse molécule soulageant les douleurs. Son fabricant obtient l’autorisation de mise sur le marché et «Lutteur-Douleur» est disponible en pharmacie. Il devient alors l’objet de surveillance par la pharmacovigilance. Mais qu’est-ce que cela signifie ?
Imaginons un nouveau médicament appelé «Lutteur-Douleur» qui est une prometteuse molécule soulageant les douleurs. Son fabricant obtient l’autorisation de mise sur le marché et «Lutteur-Douleur» est disponible en pharmacie. Il devient alors l’objet de surveillance par la pharmacovigilance. Mais qu’est-ce que cela signifie ?
Avant la mise sur le marché du médicament
Avant d’être commercialisé, un nouveau médicament, par exemple « Lutteur-Douleur » va subir de nombreux tests. Il est d’abord testé dans des éprouvettes au laboratoire, puis sur des animaux afin d’en vérifier les propriétés thérapeutiques, comme la capacité de soulager les douleurs, et les effets nocifs dits effets indésirables. Il doit ensuite franchir les études cliniques qui évaluent son efficacité et sa sécurité chez l’humain. S’il est promu à la fin de toutes ces étapes, notre « Lutteur-Douleur » obtient l’autorisation d’être mis sur le marché à disposition de la population générale.
Cependant, lorsque « Lutteur-Douleur » aura reçu l’autorisation d’être vendu en pharmacie, seul un nombre restreint de patients l’aura testé par rapport à la population générale qui va l’acheter.
Cependant la population générale est bien différente de la population restreinte inclue dans les études cliniques. La population générale présente des différences p.ex en âge, en maladie autre que les douleurs, en prise d’autre médicaments. C’est pourquoi, c’est à ce moment que des effets indésirables rares et qui n’ont pas été détectés au cours des études cliniques pourraient se manifester.
Une fois vendu en pharmacie, il y a une question importante à laquelle il faudra répondre :
« Lutteur-Douleur » provoque-t-il des effets indésirables qui n’ont pas été détectés lors des études cliniques ?
Pour répondre à cette question il est alors indispensable de suivre les effets indésirables de « Lutteur-Douleur » une fois qu’il sera acheté par de très nombreux clients dans les pharmacies. Il deviendra l’objet d’une pharmacovigilance.
Qu’est-ce que c’est la pharmacovigilance ?
Le but principal de la pharmacovigilance est d’améliorer la sécurité des patients lors de l’utilisation des médicaments. Elle surveille le marché des médicaments dans les conditions usuelles d’utilisation, à savoir une fois que le médicament est mise à disposition de la population. Elle veille à ce que la balance bénéfices/risques d’un médicament comme notre « Lutteur-Douleur » penche toujours du côté des bénéfices.
En quoi consiste la pharmacovigilance ?
La pharmacovigilance comporte plusieurs aspects tels que la détection, l’évaluation, la compréhension et la prévention des risques liés à l’utilisation d’un médicament une fois qu’il est utilisé par des milliers, voire des millions de patients. Elle rassemble à travers le monde toutes les données décrivant les effets indésirables liés aux médicaments (ces données sont appelées « notifications »).
médicament une fois qu’il est utilisé par des milliers, voire des millions de patients. Elle rassemble à travers le monde toutes les données décrivant les effets indésirables liés aux médicaments (ces données sont appelées « notifications »).
Ces notifications peuvent amener à
- modifier la notice d’emballage pour signaler un nouvel effet indésirable ou une nouvelle interaction
- retirer le médicament du marché si la balance bénéfices/risques penche du côté des risques. Ce fut le cas du rofecoxib, un analgésique retiré du marché en 2004 à cause des effets indésirables au niveau du cœur.
Et la pharmacovigilance en Suisse ?
Notre système est formé par 6 centres régionaux de pharmacovigilance (GE, VD, TI, BE, BS, ZH) et des firmes pharmaceutiques. Chaque centre reçoit les déclarations d’effets indésirables, les analyse et les transmet à Swissmedic, l’institut suisse des produits thérapeutiques chargé de surveiller le marché des produits thérapeutiques. Swissmedic récolte les données et les transmet au centre mondial de pharmacovigilance de l’OMS.
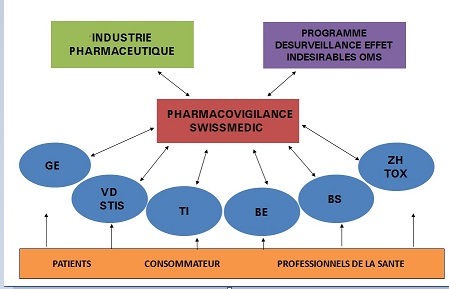
Que déclarer ?
Une déclaration efficace et utile nécessite 3 éléments fondamentaux : un patient, un médicament et un effet indésirable. Selon la loi sur les produits thérapeutiques, on doit signaler les réactions indésirables graves, inconnues ou non suffisamment mentionnées dans la notice. Le lien de causalité entre une réaction et un médicament ne doit pas être prouvé, le simple soupçon suffit pour que l’effet soit notifié.
Qui doit déclarer ?
Tout professionnel de la santé a l’obligation légale de déclarer un effet indésirable. Mais la pharmacovigilance n’est pas une tâche qui concerne uniquement les professionnels ! La sécurité d’emploi des médicaments est importante pour tous ceux et celles qui en consomment. Vous aussi vous êtes concernés ! Patients, consommateurs ou proches, vous êtes tous invités à signaler les effets indésirables et à collaborer pour la sécurité du marché des médicaments.
Comment pouvez-vous participer à améliorer la sécurité d’emploi des médicaments ?
Swissmedic met à disposition des patients un Formulaire de déclaration effet indésirable. Ce formulaire est conçu spécifiquement pour vous permettre de signaler au centre de pharmacovigilance le plus proche de chez vous, toute réaction suspecte liée à un médicament.
Soyez précis et ayez soin de remplir correctement les cases du formulaire en suivant les instructions données. Plus la déclaration sera précise, plus il sera facile d’en tirer des informations correctes et utiles. N’hésitez pas à demander conseil ou aide à votre médecin ou pharmacien pour remplir correctement le formulaire.
Merci d’avance pour votre future collaboration !
Billet rédigé et illustré par V. Mainardi
Billet relu par Dre.V. Piguet et Dre. V. Rollason
Aucun conflit d’intérêt n’est rapporté par l’auteur et relecteurs.
Références
Dre. V. Rollason « Déclaration des effets indésirables par les patients : est-ce utile et utilisable ? » , Colloque de pharmacologie et toxicologie clinique HUG

